
La filosofia dell’insulina
Prima di iniziare ad addentrarci nei meccanismi biochimici dell’insulina, è giusto cercare di inquadrare l’ormone nel contesto del nostro organismo e ancora di più nella nostra specie.
Saranno riflessioni chimico-filosofiche, ma ci aiuteranno ad entrare nel mood corretto per capire meglio il resto.
La nostra specie ha vissuto per la maggior parte del suo tempo in un contesto in cui procurarsi il cibo era difficile, si passava da mangiare magari una grande quantità di cibo in pochissimo tempo per una caccia che aveva avuto successo, e poi magari si rischiava di aspettare per dei giorni prima di poter fare un nuovo pasto.
Nel nostro passato di cacciatori raccoglitori le calorie provenivano principalmente da carne, viscere, midollo osseo, tuberi e qualche frutto d’estate, tra l’altro frutta che non aveva certo il tenore zuccherino che si è selezionato nei nostri tempi.
I ritrovamenti degli scheletri di quei tempi hanno dimostrato una densità ossea, una statura ed una dentizione eccellente, zero carie, ottima massa muscolare ed una forma fisica paragonabile ad un moderno atleta.
Il nostro sistema endocrino si è sviluppato in quel contesto, la prova viene dal fatto che noi abbiamo ben 5 ormoni che alzano la glicemia che sono:
- cortisolo
- glucagone
- adrenalina
- noradrenalina
- GH
Mentre ne abbiamo solo 1 che abbassa la glicemia, che è proprio l’insulina.
Questo testimonia che la nostra specie ha dovuto fare molto più i conti con scarse risorse che con abbondanti risorse, altrimenti la situazione sarebbe stata ben diversa.
La situazione è radicalmente cambiata con lo stanziamento e l’inizio della fase agricola, che ha coinciso con uno shift dei macronutrienti in cui si è passati da proteine e grassi ad una prevalenza di carboidrati da cereale.
Con l’inizio della fase agricola si sono persi 20 cm di altezza, tutta la struttura muscolo scheletrica si è indebolita e la carie ha iniziato a devastare la bocca delle persone, mummie e scheletri dell’antico Egitto ad esempio presentavano enormi problemi a livello di densità ossea e di carie.
Dall’era agricola siamo passati all’era dell’industria in cui il raffinamento e il processamento del cibo ha creato dei concentrati calorici inimmaginabili fino a qualche decennio prima, soprattutto l’introduzione del fruttosio da sciroppo da mais e dello zucchero bianco ovunque ha aumentato ulteriormente indici e carichi glicemici.
Un importante discorso va fatto sulla variabilità individuale, in questi millenni di esposizione ai carbo in quantità elevata ha selezionato fenotipi che sono ottimi ossidatori, per cui ci sono persone che non solo reggono molto bene i carboidrati, ma una loro assenza nella dieta mette sotto un enorme stress il loro sistema endocrino, noi oggi definiamo questa categoria ectomorfi, che sono le persone estremamente magre che fanno molta fatica a mettere su peso, probabilmente persone così nella preistoria sarebbero durate come un gatto in tangenziale, ma in un mondo con un eccesso calorico loro sono meglio adattate di un endomorfo che ha sempre problemi di resistenza all’insulina, ma questo è un discorso che faremo poi.
Nel nostro sangue circolano circa 5 grammi di glucosio, una quantità contenuta in un cucchiaino di zucchero, e la stabilità glicemica è una delle chiavi per la salute, al nostro cervello soprattutto non piace molto la glicemia che si impenna molto, che poi cala e che fa altalene eccessive.

Quando mangiate un piatto di pasta di 100 grammi, circa 90 grammi di glucosio entrano in maniera molto veloce nel sangue e alzano di moltissimo la glicemia, causando quindi un rilascio massivo di insulina che ha come scopo primario l’abbassamento della glicemia e consentire al glucosio di entrare nelle cellule che espongono il recettore GLUT4, quello insulino-sensibile, ma vedremo poi anche questo.
Per il nostro organismo l’insulina è sinonimo di abbondanza, è il segnale che c’è una buona quantità di calorie che consentono una spinta anabolica del nostro metabolismo, la secrezione di insulina infatti si accompagna alla secrezione dei fattori di crescita insulino-simili, che si chiamano IGF, che hanno una funzione trofica su tutti i tessuti dell’organismo, se abbiamo un elevato tasso di insulina allora avremo:
- una maggior sintesi proteica, i muscoli cresceranno
- una maggiore crescita del tessuto adiposo
- una maggiore produzione di colesterolo e trigliceridi
- un aumento del trofismo tissutale
Durante le fasi ad alta insulina il nostro organismo blocca la gluconeogenesi e l’ossidazione degli acidi grassi, perché non ha bisogno di accedere alle riserve, è un buon momento per crearne di nuove…
L’entrata del glucosio nelle cellule è davvero complessa, esistono molti diversi trasportatori, su cui vale la pena fare un post approfondito, ognuno con diversa capacità e affinità al glucosio, ma l’unico che funziona sotto effetto dell’insulina è il GLUT4.
In pratica il trasportatore insulino-sensibile che è espresso principalmente nei muscoli e nel tessuto adiposo è il principale target dell’azione ipoglicemizzante dell’insulina.
Il fegato esprime invece i recettori IRS 1 e 2, e questo aspetto è fondamentale, poiché uno dei ruoli principali del fegato è mantenere la glicemia, deve essere istruito sul da farsi, produrre glucosio se ci troviamo in carenza glicemica, o stoccarlo sotto forma di glicogeno e acidi grassi se siamo in eccesso.

Il primo livello di signaling dell’insulina
Abbiamo visto quale sia la filosofia che guida l’azione dell’insulina, ora andiamo a vedere come si traduce la filosofia in biochimica, e qui si aprono scenari incredibilmente complessi.
L’insulina è un ormone altamente pleiotropico, che tradotto in linguaggio basic significa che la sua azione ha moltissimi effetti diversi su tessuti molto diversi. Vedremo che ha effetti diversi anche in base all’età dei soggetti.
Per Madre Natura riuscire a dare tante funzioni diverse ad un solo ormone significa costruire una cascata di attivazioni di incredibile complessità, che vede in azione decine di diversi enzimi e proteine diverse, cercheremo di andare a vederle una per una, in modo da vedere poi dove si instaureranno i meccanismi di insulino-resistenza e capire a fondo tutti i meccanismi che ci portano ad essere sempre più diabetici e sempre più infiammati.
Questo post sarà scritto in due modalità, la prima di livello di approfondimento post-universitario per i tecnici che vogliono andare a fondo dei meccanismi che per loro sono fondamentali, e poi in maniera molto più semplice per tutti gli altri utenti, quindi se non capite la prima parte, scendete qualche riga e troverete tutto ben chiaro.
Questo parte è dedicata solamente alla spiegazione della cascata del recettore INSR e della sua regolazione di membrana, la prossima parte descriverà l’effetto dell’insulina nei vari tessuti target, muscolo, adiposo ed epatico.
Il signaling per secchioni
Il recettore target per l’insulina è un recettore transmembrana eterotetramerico, composto da due subunità alfa extracellulari che legano l’insulina e due subunità Beta endocellulari che hanno funzione tirosino-kinasica.
Del recettore INSR esistono due isoforme, A e B, la forma adulta è la B, la forma A è una forma fetale/neonatale che ha maggiore affinità con la segnalazione insulinica legata all’IGF e alle MAP kinasi.
Ovviamente questa è una genialata di madre natura, che consente di massimizzare l’azione mitotica e trofica dell’insulina nel momento del massimo bisogno di sviluppo cellulare, per passare poi ad una più importante funzione metabolica una volta che diventa più importante la funzione di regolazione della glicemia e del controllo energetico in generale.
Una volta che l’insulina si lega alla subunità alfa l’attivazione del recettore consiste in una triplice fosforilazione nelle tirosine:
- 1162
- 1158
- 1163, in questo preciso ordine

Una sola molecola di insulina attiva il recettore, e rende meno affine il legame dell’altra subunità, quindi per avere un legame di entrambe le subunità serve una concentrazione molto più alta di insulina, e da recenti studi sembra che il legame con due molecole di insulina implichi una maggior risposta mitogenica rispetto ad un legame singolo.
Tradotto in altre parole un livello molto alto di insulina favorisce le funzioni trofiche dell’ormone, a scapito di quelle metaboliche.
Questo meccanismo lo vedremo meglio quando parleremo di insulino-resistenza.
La fosforilazione di INSR dà il via alla cascata di fosforilazioni che riguardano GRB2, SH2B2 e SHC, quest’ultima più implicata nell’attività mitogenica, mentre le altre nell’attività metabolica.
La fosforilazione più importante è quella di IRS, che il principale responsabile dell’azione metabolica dell’insulina e di cui esistono 6 isoforme, sebbene le più rappresentate siano la 1 e la 2 e dalle isoforme presenti si stabilisce quale tipo di azione metabolica derivi dall’effetto dell’insulina, ovviamente fegato muscolo e adipe presentano isoforme diverse in accordo alle loro funzioni.
IRS presenta una grande quantità di siti ricchi in tirosine, quindi altamente fosforilabili e dà quindi una enorme amplificazione del segnale, la sua attivazione è quella che fornisce i feedback di regolazione del pathway, essendo bersaglio della S6K, e questo è un altro meccanismo molto importante per lo sviluppo di insulinoresistenza.
IRS attiva a sua volta un’altra kinasi, la PI3K, che presenta a sua volta 5 isoforme codificate da 3 geni, PIK3r1, PIK3r2, PIK3r3, in biochimica dove esistono isoforme esistono diverse sfumature di azione, e anche qui non ci sono eccezioni.
Sono state molto studiate le differenti isoforme, soprattutto in topi che venivano messi KO per specifiche isoforme e che presentavano anomalie nella tolleranza al glucosio, topi senza questa kinasi sono in pratica diabetici di tipo 1 perché non si esplica l’azione dell’insulina a livello metabolico.
Da buona Kinasi PI, la sua funzione è produrre PIP3, la reazione inversa è catalizzata da PTEN una fosfatasi che viene inibita dall’insulina stessa, favorendo l’accumulo di PIP3.
Il PIP3 attiva AKT, che il vero effettore metabolico dell’azione dell’insulina. A prova del fatto si è trovata nella popolazione finlandese una mutazione che rendeva AKT parzialmente attivata, portando ad un forte aumento nell’uptake di glucosio muscolare ed adiposo, con un aumento della gluconeogenesi epatica per contrastare la continua ipoglicemia.
Il signaling PI3k/AKT è potenziato dall’attivazione di GIV, che diventa un fattore di amplificazione dell’azione prossimale dell’insulina.
Quindi per ricapitolare IRS/PI3K/AKT sono la via preferenziale di early signaling dell’insulina, vedremo poi cosa questo significhi nei vari tessuti target.
Feedback negativo di INSR
Come ben sappiamo ogni recettore che viene attivato deve poter essere disattivato, altrimenti resterebbe costitutivamente attivo, con conseguenze assai poco piacevoli, quindi l’INSR prevede diversi meccanismi di feedback negativo, i principali sono 2, la solita defosforilazione da parte di una fosfatasi, che è PTP1B, una internalizzazione mediata da CEACAM1 che a sua volta è un target dell’azione di INSR.
È molto importante capire il concetto di internalizzazione del recettore, una volta che un recettore è stato usato, viene defosforilato ed internato all’interno della cellula, rendendolo non disponibile ad un legame con l’insulina, mentre viene esternalizzato quando la cellula ha bisogno di glucosio, massimizzando l’attività insulinica.
Un terzo meccanismo è mediato da mTOR che sia tramite GRB10 che S6K1 blocca l’amplificazione kinasica su due punti, su IRS e direttamente sulle tirosine di IRS.
mTOR è una molecola molto studiata, perché legata alla lunghezza dei telomeri e all’antiAge
Spendo qualche parola in più su questi meccanismi, perché c’è del grande genio in chi ha costruito questi meccanismi.
Questo sistema che prevede una amplificazione molto forte in una primissima fase del legame insulinico e di una efficacissima frenata dell’attivazione non appena l’azione insulinica non è più necessaria.
Questo meccanismo consente una fantastica regolazione glicemica, che se non fosse così efficace precipiterebbe a valori da coma in pochi minuti non appena la secrezione insulinica aumenta e consente il mantenimento di una glicemia accettabile anche sotto carico, quando mettiamo 200 grammi di zucchero in un sistema che normalmente ne ha 5.
Ovviamente un meccanismo che ha così tanti attori e così tante diverse proteine espresse è un sistema che è più prono a fattori genetici dove il possedere isoforme meno performanti di qualche key-protein rende più probabile lo sviluppo di insulino-resistenza in famiglie maggiormente predisposte con tare genetiche particolari.
Il signaling per non addetti ai lavori
Se avete avuto il coraggio di leggere la prima parte, avrete capito la complessità del meccanismo, che al di là dei dettagli tecnici si può spiegare molto facilmente in poche righe…
L’insulina lega INSR che è il suo recettore presente in tutte le cellule target, muscolo, adipe e fegato.
Una volta legata parte una cascata molto complessa di reazioni che servono per amplificare il segnale, in modo che una sola molecola di insulina possa attivare decine di migliaia di molecole target, che consentono all’insulina di svolgere azioni diverse nei vari tessuti, proprio in base al tipo di cascata che ne deriva.
L’attivazione di INSR darà il via all’effetto metabolico dell’insulina che consiste nel rimuovere il glucosio dal circolo ematico e portarlo dentro le cellule, dove in base al tipo di cellule ci sarà un particolare effetto:
- il muscolo costruirà glicogeno
- Il fegato costruirà glicogeno, acidi grassi e smetterà di produrre glucosio
- Il grasso produrrà altro grasso… e questo nozzy lo sa bene
La regolazione del recettore è fatta in maniera tale che se siete a digiuno da parecchio tempo o avete fatto molta attività fisica le cellule avranno una grande avidità per l’insulina e per il glucosio, mentre se passate molte ore sul divano con le patatine e la coca – cola ci saranno pochissimi recettori INSR disponibili e per mantenere la glicemia dovrà essere prodotta moltissima insulina per legarsi a quei pochi siti di legame.
Riassunto finale per tutti:
- Mangiate zuccheri nelle quantità adeguate e ben divisi nella giornata senza mai generare grandi picchi
- Fate attività fisica, che è una delle maniere più furbe di evitare e di invertire l’insulino-resistenza
Il meccanismo di azione dell’insulina nei tessuti target
Ritengo che sia primario conoscere i meccanismi alla base di una delle più importanti patologie moderne, il diabete di tipo 2, che è un tassello fondamentale anche nella medicina funzionale per quanto riguarda la sua stretta correlazione con il sistema immunitario e l’infiammazione in genere.
Anche ora parleremo di fisiologia, per cui il meccanismo NORMALE di azione dell’insulina, parleremo dei meccanismi patologici non appena avremo terminato tutto il quadro.
Eravamo rimasti su come l’insulina attraverso la sua cascata di effettori principali, IRS1, PI3K e AKT2 amplifichino e siano a loro volta inizio di percorsi metabolici specifici per ogni tessuto.
I principali tessuti target, non sono gli unici lo vedremo la prossima volta, sono:
- Fegato
- Muscolo scheletrico
- Tessuto adiposo bianco che chiameremo WAT per brevità.
Ognuno di questi 3 tessuti ha funzioni specifiche e di conseguenza il signaling insulinico che è simile per tutti deve poi differenziarsi in base al risultato finale che vogliamo ottenere.
Per dirla in brevissimo le funzioni dei 3 tessuti insulina-linked sono:
- Fegato: mantenimento della glicemia, produzione di acidi grassi, proteine con ogni tipo di funzione, aminoacidi liberi (e molto altro, ma vedremo in seguito)
- Muscolo: sintesi di glicogeno per avere carburante di pronto utilizzo per l’attività contrattile
- WAT: trasformazione degli zuccheri in grassi e stoccaggio di energia sotto forma di trigliceridi
Se ricordate la prima parte che ci raccontava la filosofia dell’insulina, potete facilmente unire i puntini, per l’organismo un alto tasso di insulina è sinonimo di una grande energia disponibile, ragion per cui diventa un ottimo momento per privilegiare le funzioni anaboliche, quindi fare scorta di energia sotto forma di grassi o di glicogeno, e sintetizzare le molecole necessarie alla sopravvivenza come il colesterolo e nuovi aminoacidi.
Sappiamo che nella nostra specie i momenti iperinsulinemici erano molto rari in passato, per il nostro organismo era normale avere un tasso di insulina sempre piuttosto basso, e vedere una impennata dopo i pasti.
Ad oggi la stimolazione insulinica è ovviamente enormemente maggiore dovuto al maggior carico glicemico dei cibi ultraraffinati, e non per nulla il DM2 è diventata una emergenza sanitaria.
Andiamo adesso nel dettaglio…
L’effetto dell’insulina nel muscolo

Il muscolo presenta il solito recettore INSR che dà il via alla cascata che abbiamo visto, l’effetto netto dell’insulina è quello di aumentare l’uptake di glucosio dal plasma e la sua polimerizzazione di glicogeno.
Topi ko per il GRB10 che perdono la capacità di inibire l’INSR, tendono ad essere ipoglicemici e ad avere un costitutivo aumento del flusso di glucosio nel muscolo.
L’AKT più espresso e importante è il 2, vedremo poi perché.
L’azione più importante è l’esternalizzazione del recettore GLUT4, che normalmente è mantenuto in vescicole nel citoplasma e attraverso l’azione di AKT, mediata da AS160 e RAC1, consente la messa in moto del motore citoscheletrico che trasporta il glut4 all’esterno e lo fonde con la membrana.
Una volta che il glut4 è adeso alla membrana diventa un canale specifico per il glucosio che consente il passaggio del glucosio all’interno della cellula, dove verrà fosforilato da una esochinasi in glucosio 6P che per via della polarità non potrà uscire dalla cellula, e abbattendo le concentrazioni di glucosio consentirà ad altro glucosio di poter entrare nella cellula, cosa che sarebbe impedita se le concentrazioni si eguagliassero.
La proteina AS160, conosciuta anche come TBC1D4 è sede di una mutazione, piuttosto rara, ma presente nella popolazione che la rende meno affine all’effetto di AKT2, rallentando l’azione di insulina nel muscolo, questa è una delle rare, ma possibili forme di insulinoresistenza periferica.
Nel soggetto sano la sua fosforilazione rimuove il freno che impediva la traslocazione del GLUT4.
Varianti anomale di RAC1 portano ad una esposizione di GUT4 anche senza l’azione dell’insulina.
Per ricapitolare con altre parole, una volta che l’insulina si lega il canale GLUT4 viene esposto e diventa un passaggio per il glucosio che dal plasma ha una strada per entrare nel muscolo.
Una volta che il glucosio entra nel muscolo ha due possibilità, la glicolisi, che avviene per circa il 25% del totale e la glicogenosintesi, per il restante 75%.
È importante ricordare che ad un aumento del glucosio corrisponde anche un aumento della glicolisi, anche se sotto effetto di insulina la funzione privilegiata è lo stock energetico.
Per incentivare la glicogenosintesi l’insulina agisce sulla glicogenosintasi (GS) upregolandola, che sulla glicogenofosforilasi (GP) downregolandola. L’attivazione della GS avviene attraverso la defosforilazione dei suoi residui di serina, quindi l’insulina attiva la GS indirettamente, andando primariamente ad inattivare la kinasi che inattiva la GS e attivando la fosforilasi che la attiva.
Mi sa che ho scritto un po’ contorto, ma si capisce il senso, purtroppo non riesco a trovare modalità più semplici…
La GS in realtà è un sistema scaffold che contiene tutto il sistema enzimatico che svolge le varie tappe della glicogenosintesi. L’insulina nel muscolo specularmente blocca anche la glicogenofosforilasi impedendo quindi che molecole di glicogeno vengano demolite durante un momento di abbondante disponibilità energetica.
L’insulina a livello muscolare promuove anche l’uptake di aminoacidi e favorisce la sintesi proteica, diventa anche un ormone anabolico quindi assai importante per il trofismo muscolare.
I bambini diabetici di tipo 1, in assenza di insulina di solito sono molto magri e con una massa muscolare quasi assente, per poter avere un normale trofismo necessitano di insulina esterna.
L’effetto dell’insulina nel fegato

Qui le cose si complicano enormemente, il fegato è l’organo in cui l’insulina regola moltissime vie metaboliche, ma cerchiamo di vedere solo quelle legate al glucosio.
Una cosa che in pochi considerano è la fisiologia della secrezione insulinica, il pancreas riversa l’insulina neoprodotta direttamente nella vena porta, che ha il fegato come organo meta, per dirla in altri termini nel fegato l’insulina arriva subito e con concentrazioni da due a 3 volte più alte rispetto ai tessuti periferici.
I tessuti più distali ricevono una minore concentrazione di insulina, e infatti i piedi ad esempio sono i primi che soffrono dei danni da diabete…
Quando si inietta l’insulina esterna, la fisiologia non viene rispettata, perché in sottocutanea tende a distribuirsi equamente in tutto il circolo sanguigno, e diventa quindi necessario essere molto attenti con i dosaggi.
Il fegato è l’organo atto a mantenere la glicemia, il suo lavoro è quello di fare in modo che nuovo glucosio venga continuamente prodotto per poter essere mantenuto costante nel sangue, di norma l’iperglicemia è di breve durata e post prandiale, per la gran parte della giornata la glicemia è mantenuta proprio dall’attività epatica.
Per poter mantenere la glicemia il fegato ha due diverse modalità, la gluconeogenesi, producendo quindi glucosio a partire da substrati non glucidici, come il glicerolo o gli aminoacidi e la glicogenosintesi, quindi la degradazione del glicogeno precendetemente stoccato.
Ho aggiunto un grafico che mostra nel tempo in che percentuale i due sistemi lavorano, nelle primissime ore di digiuno la glicogenolisi rappresenta circa il 50% della produzione totale di glucosio, mentre col passare del tempo la gluconeogenesi diventa sempre più importante.

Vedremo nel dettaglio come l’insulina blocchi entrambi questi meccanismi, nel diabete l’incapacità dell’insulina di bloccare la gluconeogenesi è il motivo per cui la glicemia a digiuno schizza alle stelle, anche con elevata insulina circolante, e glucosio in abbondanza, il fegato continua a produrre e rilasciare neoglucosio in circolo.
Nel fegato vediamo la presenza sia di IRS1 che IRS2 con simili funzionalità.
L’azione di AKT2 ha due target primari, mTORC1, che avvia il ruolo di sintesi proteica e lipidica, e FOXO1, che è un fattore di trascrizione nucleare fondamentale, visto che la sua azione a livello nucleare è quella di promuovere la trascrizione degli enzimi gluconeogenetici.
Questo fondamentale fattore di trascrizione che è normalmente attivo nel nucleo a seguito dalla sua fosforilazione da parte di AKT esce dal nucleo interrompendo la produzione di enzimi atti a produrre nuovo glucosio.
L’ingresso del glucosio nel fegato non avviene grazie all’insulina, il fegato infatti non esprime GLUT2, ma GLUT2 costantemente in membrana, il trasportatore è ad alta capacità e bidirezionale.
Il glucosio che entra in maniera concentrazione dipendente viene fosforilato dalla glucochinasi, che non è come la classica esochinasi, la sua proprietà è quella di non essere inibita dal glucosio, quindi continuerà a fosforilare a ciclo continuo.
La maniera forse più importante con cui l’insulina blocca la gluconeogenesi epatica è quella di bloccare la lipolisi nel WAT, la diminuzione del glicerolo come substrato determina un grosso stop per la produzione di nuovo glucosio. Il fegato preferisce fare glucosio dalla glicerina che dagli aminoacidi.
Per quanto riguarda la sintesi di glicogeno la regolazione è più o meno la medesima del muscolo.
Ovviamente il fegato è dotato della glucosio 5 fosfatasi, che rende possibile per il glucosio uscire dall’epatocita ed entrare in circolo, cosa impossibile per tutti gli altri tessuti, nei quali il glucosio una volta entrato non potrà più uscire.
Per il fegato basta così, se no andiamo a complicare eccessivamente, passiamo al tessuto adiposo che ha le sue particolarità.
Effetto dell’insulina nel tessuto adiposo o WAT
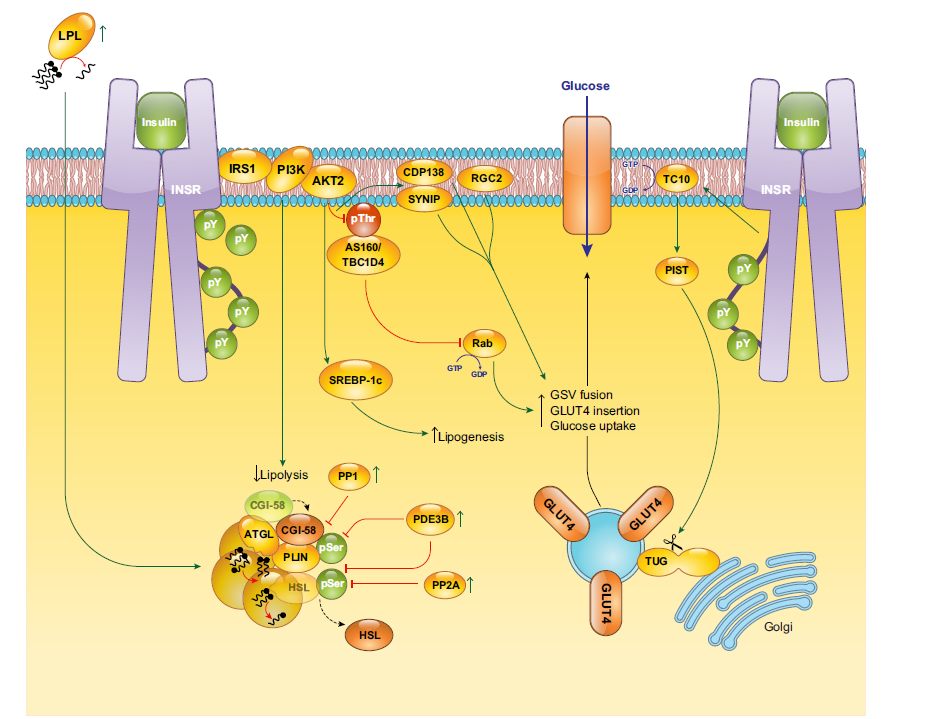
Visto che siamo molto fortunati, il tessuto adiposo è il più avido di insulina, per cui un alto tasso di insulina si tradurrà in un effetto molto marcato sul tessuto adiposo.
A farla breve un alto tasso di insulina favorirà la sintesi di nuova ciccia, un basso tasso di insulina invece promuoverà la lipolisi.
Per ricordare come è composto un trigliceride, sappiamo che 3 molecole di un acido grasso sono esterificati ad uno scheletro di glicerina, che è un trialcol con 3 atomi di carbonio.
Una volta che il legame esterico verrà rotto avremo la liberazione degli acidi grassi liberi o NEFA, e del glicerolo.
Il glicerolo sarà substrato per la gluconeogenesi, mentre gli acidi grassi liberi saranno usati per essere bruciati, tramite la beta ossidazione, oppure convertiti in corpi chetonici, oppure utilizzati per produrre altri lipidi di tipo plastico.
L’uptake di glucosio nel tessuto adiposo è piuttosto simile al muscolo, abbiamo anche qui l’esternalizzazione del GLUT4 sotto azione dell’insulina che favorisce l’entrata del glucosio nell’adipocita.
Sappiamo che l’adipocita ha pochissima acqua citoplasmatica, essendo in pratica una goccia di grasso con un nucleo schiacciato vicino alla membrana, per cui il glucosio deve essere prontamente trasformato in trigliceridi e stoccato.
Il signaling dell’insulina nell’adipocita ha il principale ruolo di fermare la lipolisi, quindi per dirla in altre parole con l’insulina alta non si dimagrisce, e lo fa attraverso l’attivazione della fosfodiesterasi 3B (PDE3B), attenuando il segnale dell’AMPciclico attraverso la Perilipina e l’HSL (lipasi ormono-sensibile).
Quindi per dirla in altre parole, a bassa insulina vengono favoriti i processi di distacco e scomposizione dei trigliceridi, che vengono scissi in NEFA, e glicerolo. Il glicerolo è uno dei principali substrati per la gluconeogenesi epatica, e quindi il glicerolo circolante è uno dei maggiori controllori dell’attività neoglucogenetica epatica.
Nei momenti ad alta insulina invece accade il contrario, i grassi non vengono più scissi, ma vengono sintetizzati e vanno ad arricchire il nostro patrimonio energetico di riserva, che anche se ad oggi ci dicono che è una cosa negativa, per il nostro organismo che è ancora abituato in termini di massimo risparmio energetico è materiale ossidabile estremamente prezioso.
Nel prossimo articolo vedremo i meccanismi di insulino-resistenza e come invertirli:
https://www.psoriasimetodoapollo.com/meccanismi-della-insulino-resistenza-parte-2/
Ad Majora









