La Vitamina D nella psoriasi: meccanismi molecolari e potenziale terapeutico
Finalmente siamo riusciti ad andare avanti con la serie dedicata alla vitamina D, è passato un po’ di tempo, ma ne è valsa la pena.
Della vitamina D si parla moltissimo sul web, se ne parla moltissimo anche a livello di ricerca mondiale, tanto è vero che negli ultimi anni stanno uscendo moltissimi studi, che confermano poi punto per punto quello che noi dicevamo già 10 anni fa, e per questo guardati come alieni.
Per fortuna in questi anni i concetti alla base dell’efficacia della vitamina D come immunomodulante sono arrivati alla massa, sono aumentate le prescrizioni di vitamina D e sono aumentate esponenzialmente le richieste per verificare il livello di vitamina D nel sangue, con non poche polemiche da parte dei medici di famiglia, che si sono visti richiedere cose che per legge non possono prescrivere.
Prima di addentrarci nell’articolo vogliamo fare una premessa a difesa dei medici di famiglia e del bilancio del SSNN, ricordandoti che le linee guida mondiali sull’uso della vitamina D sono molto distanti rispetto alle potenzialità a livello terapeutico e preventivo della sostanza, non siamo d’accordo, ma le regole sono regole.
Ad oggi ogni operatore del SSNN è obbligato ad attenersi a delle regole che sono a salvaguardia del bilancio dello stato, con una pressione enorme a rimanere nei budget, quindi è più che comprensibile che alla richiesta di prescrizione di vitamina D e di dosaggi periodici venga posto un rifiuto.
Chi usa la vitamina D “off-label”, magari seguito da un medico funzionale, deve entrare nell’ottica che è una sua scelta, e per quanto indigesta come idea, deve provvedere da solo al pagamento delle analisi e dell’integrazione senza gravare sul SSNN.
La realtà dei fatti è che la vitamina D comprata come integratore sia in realtà enormemente più economica della vitamina D comprata come farmaco, per capirci 20 o 30 euro possono bastare per un anno di integrazione, e il costo del dosaggio della vitamina D pagato di tasca propria non è poi così distante dal prezzo che si paga con il ticket.
In chi soffre di malattie autoimmuni poi la vitamina D gioca un ruolo più che primario e il follow-up che ne attesti la corretta integrazione azzerando in pratica i rischi, che esistono se ne viene abusato l’utilizzo, dovrebbe essere messo in assoluta priorità.
Questa seconda parte si basa su uno studio estremamente approfondito che sviscera in maniera molto completa la correlazione tra il sistema immunitario e la vitamina D, lo studio è del 2017 pubblicato su una rivista a noi molto cara che è “Frontiers in Immunology”.
Vitamin D in Autoimmunity: Molecular Mechanisms and Therapeutic Potential
Wendy Dankers1,2, Edgar M. Colin1,3, Jan Piet van Hamburg1,2 and Erik Lubberts1,2*
L’articolo è liberamente scaricabile a questo link:
https://www.frontiersin.org/articles/10.3389/fimmu.2016.00697/full
Purtroppo ci troviamo costretti a mantenere un linguaggio un po’ tecnico, questi argomenti per essere affrontati in maniera corretta richiedono l’uso del corretto lessico scientifico, faremo il meglio possibile per essere chiari e comprensibili.
Prima di tutto è interessante capire come mai negli ultimi 30 anni si è passato da pensare alla vitamina D come coinvolta in maniera esclusiva nel metabolismo del calcio, ad una sostanza con un potente effetto pleiotropico con fondamentali correlazioni immunitarie.
Si è visto che molto spesso il soffrire di malattie autoimmuni e la gravità della patologia stessa ha dei profondi legami con polimorfismi legati al VDR, il recettore della vitamina D, si sono correlate alterazioni genetiche della struttura del recettore, che portavano ad una minore efficacia della vitamina D a livello organico, ad una maggiore possibilità di sviluppo di autoimmunità.
Prima di buttarti a leggere il core dell’articolo ti invitiamo a rileggere la prima parte di questo articolo, che introduce la vitamina D, il suo metabolismo e i suoi meccanismi:
https://www.psoriasimetodoapollo.com/vitamina-d-parte-1/
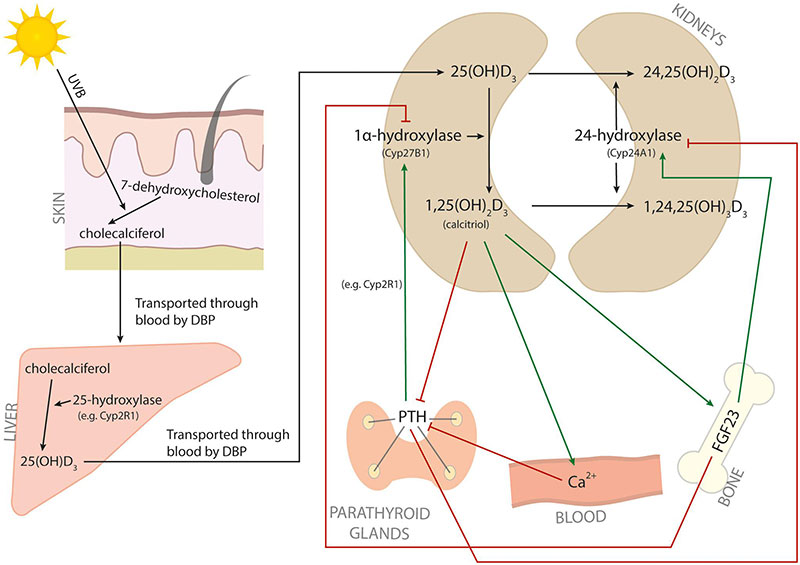
Vitamin D metabolism. The metabolic pathway of vitamin D. Red arrows indicate inhibition, and green arrows indicate induction.
La vitamina d e le malattie autoimmuni: Epidemiologia
È interessante ricordare che il sospetto di questo legame tra la vitamina D e le malattie autoimmuni sia nato osservando dati epidemiologici, dove si è notato che tanto più ci si allontana dall’equatore e ci si sposta verso climi temperati prima o sub-polari poi, tanto più aumenti l’incidenza di sclerosi multipla, morbo di Crohn e artriti. Si è visto inoltre che anche il mese di nascita incideva sull’incidenza di queste patologie, con un rischio massimo nei nati ad Aprile ed un rischio minore per i nati tra ottobre e novembre.
L’unica correlazione che poteva spiegare queste differenze era da ricercare nel cambiamento dell’esposizione ai raggi UV della madre durante la gestazione, e per ulteriore conferma questo succede solamente nelle aree in cui c’è una forte variazione della quantità di raggi UV durante l’anno, proprio come accade nei climi nordici, visto che nelle aree tropicali ed equatoriali la composizione UV rimane abbastanza costante durante tutto l’anno.
Visto che la vitamina D può essere introdotta anche per via alimentare, occorreva capire se questa correlazione è valida anche per le fonti non solari di vitamina D, ed anche qui si è visto che l’integrazione con olio di fegato di merluzzo riduceva l’incidenza di diverse patologie autoimmuni.
Ora occorre essere scientificamente precisi, nonostante i forti sospetti della correlazione tra bassi livelli di 25(OH) D nel sangue e maggior rischio di sviluppare malattie autoimmuni, non è facile fare lavori attendibili, proprio per l’enorme differenza individuale nel metabolismo della vitamina D, sappiamo bene che ci sono persone che con 40-50 ng/ml raggiungono il massimo dell’attività, mentre ad altre servono 80/90 ng/ml per vedere l’azione metabolica della vitamina D.
Quello che invece è certo e facilmente misurabile che persone con polimorfismi del VDR hanno un evidente maggiore rischio di sviluppare patologie autoimmuni e con una maggiore gravità.
Sono stati testati tutti i principali polimorfismi: Apa1, BSM1, Taq1 e Fok1
Ricapitolando quindi, lo sviluppo e la gravità della patologia autoimmune è legato a:
- livello di vitamina D nel sangue
- intake di vitamina D alimentare
- esposizione ai raggi UV
- polimorfismi del VDR
A conferma di questo fatto si è visto che la somministrazione di 1.25OHD, la forma attiva della vitamina D è in grado di sopprimere e ridurre la patologia nei modelli animali da esperimento.
Sono stati fatti diversi studi sull’uomo somministrando vitamina D in malati di artrite reumatoide, Crohn, Sclerosi Multipla, Psoriasi e Lupus; si sono ottenuti sempre risultati piuttosto incerti, tranne che nella psoriasi, dove i risultati sono stati netti e precisi, al punto tale che si sono sviluppate poi terapie topiche a base di derivati della Vitamina D, proprio sfruttando il potere immunomodulante.
Negli altri casi i dosaggi sono stati a nostro avviso bassi per arrivare ad un reale effetto, ma occorre sempre ricordare che le patologie autoimmuni sono molto complesse e plurifattoriali, la vitamina D va vista solo come un elemento in una vasta serie di meccanismi assai complessi.
Pathways immunomodulatori della vitamina D
Veniamo adesso quindi al clou dell’articolo, in questa parte andremo ad approfondire la biochimica immunitaria della vitamina D, cercando di spiegare i meccanismi che vengono attivati distinguendoli per ogni tipologia di cellula immunitaria.
Occorre specificare che OGNI cellula del nostro sistema immunitario esprime il VDR, che è una proteina citoplasmatica che si lega alla vitamina D, ad attività recettoriale che poi traslocando nel nucleo avvia una precisa sequenza di trascrizioni geniche ad azione pleiotropica, quindi con molteplici outcome.
Ad ulteriore conferma del fortissimo legame tra la vitamina D ed il sistema immunitario, monociti, linfociti B e T, macrofagi e APC sono in grado di attivare autonomamente la vitamina D, creando di fatto una microregolazione locale in cui nelle aree infiammate la concentrazione di 1.25OHD sarà maggiore, a tutto beneficio del funzionamento del sistema immunitario.

The anti-inflammatory effects of 1,25(OH)2D3 on cells of the immune system. An overview of the anti-inflammatory effects of 1,25(OH)2D3 on the cells of the immune system in autoimmunity. Red dots represent pro-inflammatory cytokines, while green dots represent anti-inflammatory cytokines. Red arrows indicate decreased differentiation, and green arrows indicate increased differentiation. References: CD8+ T cells (79–81); innate lymphoid cells (82–86); unconventional T cells (87–89); B cells (75, 90–96); dendritic cells (97–103); macrophages (104–108); CD4+ T cells (109–125)
Andiamo adesso ad analizzare il comportamento delle singole cellule immunitarie sotto l’effetto della vitamina D
Cellule Dendritiche
Questo tipo di cellule, dette anche APC o antigen-presenting cells hanno la funzione di esporre l’antigene non self ai linfociti soprattutto T, per facilitare il riconoscimento da parte del nostro sistema immunitario di potenziali invasori e attivare quella cascata di reazioni che porta all’eliminazione del potenziale rischio.
Queste cellule sono particolarmente concentrate nelle zone del nostro corpo maggiormente esposte a potenziali invasioni, come la pelle, l’intestino e i polmoni, una volta riconosciuto un antigene migrano nel tessuto linfoide per stimolare lo specifico linfocita T che risponde a quello specifico antigene. Ad essere pignoli questo tipo di presentazione viene fatta sul complesso HLA, ed è per questo che alcuni HLA particolari sono legati ad una maggiore possibilità di soffrire di determinate patologie soprattutto autoimmuni.
In questo tipo di cellule la vitamina D agisce direttamente nella differenziazione midollare, le cellule dendritiche derivano dalla linea monocitaria, in presenza di vitamina D restano in una forma intermedia tollerogenica che prevede una diminuzione di produzione di IL12 e di TNF-alfa. Una volta che la cellula è maturata pienamente, ha riconosciuto un antigene e ha dato il via alla sua cascata immunitaria, la vitamina D non ha più alcuna funzione. Anche qui c’è una eccezione che ci riguarda direttamente, sembra che solamente le APC della pelle rimangano sensibili all’effetto della vitamina D, rientrando in uno stato tollerogenico anche a maturazione completata.
Proprio sulla base di questi studi nascono i trattamenti topici a base di derivati della vitamina D.
Macrofagi
I macrofagi svolgono un doppio ruolo, da una parte hanno attività di presentazione antigenica come le APC, ma dall’altra hanno il ruolo di spazzini per la loro attività di fagocitosi. Hanno anche un ruolo importante nella secrezione delle citochine di regolazione immunitaria, che svolgono funziona attivante, chemotattica e di regolazione tra infiammazione e ricostruzione.
Qui purtroppo occorre essere precisi ed andare nel tecnico, i macrofagi si dividono in due grandi categorie: M1 ed M2, con funzioni in pratica opposte:
- I macrofagi M1 sono promotori dell’infiammazione, producono NO, TNF-alfa, Il23, IL1-beta, IL2 e promuovono la differenziazione dei linfociti T in TH1 e TH17.
- I macrofagi M2 invece sono forti produttori di IL10, che è una citochina a carattere regolatorio che promuove la ricostruzione ed un ritorno ad una normale omeostasi.
Come è possibile immaginare i macrofagi, che sono cellule residenti, hanno un ruolo primario anche nello sviluppo di autoimmunità, soprattutto sieronegativa come la psoriasi, perché sono dei coordinatori dell’immunità innata ed il loro ruolo è quello di anello di collegamento tra l’immunità innata e l’immunità adattativa.
La vitamina D interviene in due modalità, da una parte in una prima fase dell’infezione promuove lo sviluppo di macrofagi a partire dalla linea monocitaria, garantendo una maggior “potenza” immunitaria, ma in una infiammazione cronica, promuovono il fenotipo M2 a carattere regolatorio, ed è questo l’effetto che ci interessa maggiormente. È anche uno dei motivi per cui la vitamina D è uno strumento molto intelligente di regolazione immunitaria, garantendo una piena efficacia quando serve, cioè in una infezione e privilegiando il controllo immunitario in una fase infiammatoria cronica.
Linfociti B
Qui andiamo davvero nel molto complesso, soprattutto per chi è digiuno di immunogenetica, ma cerchiamo di farla facile. I linfociti B sono le cellule del sistema immunitario che producono gli anticorpi, sono in pratica le fabbriche che ci mettono a disposizione le nostre armi più efficaci contro i patogeni. Purtroppo oltre ad anticorpi contro i nostri nemici alcuni linfociti B producono una serie di anticorpi auto-reattivi che sono responsabili di diverse patologie autoimmuni siero-positive.
Tra questi abbiamo ANA, ENA, ASCA, ACPA e tutta una serie di autoanticorpi che si ricercano per fare diagnosi di patologie reumatologiche principalmente.
Oltre alla produzione di anticorpi, le cellule B hanno la capacità di secernere citochine proinfiammatorie che amplificano ulteriormente la risposta immunitaria.
La produzione di anticorpi sempre più affini all’antigene è un processo lungo, i linfociti dapprima producono IgM, che sono anticorpi non precisissimi, poi eseguono uno switch genetico e producono IgG, che sono anticorpi molto migliori. Dalle IgG abbiamo ulteriori piccole correzioni che rendono un anticorpo particolarmente affine all’antigene che deve legare, si usano infatti test di avidità anticorpale per valutare il timing di una infezione, ad esempio per la toxoplasmosi.
La vitamina D ha anche qui un doppio ruolo, promuove una buona produzione anticorpale di linfociti B con anticorpi molto affini e riduce invece la proliferazione di cellule B non swichate, con anticorpi poco affini e ne inibisce lo switch di classe.
Ovviamente la maggior parte degli autoanticorpi è poco affine e beneficia da questo effetto inibitorio, si è visto infatti che la concentrazione degli ANA è inversamente collegata al livello di 25OHD.
Si è visto che la vitamina D nel linfocita B diminuisce l’espressione di CD86, diminuendo la funzione di APC che comunque è propria anche dei linfociti B.
Su queste correlazioni ci sono comunque ancora molti aspetti poco chiari e che sono tutt’ora oggetto di studio.
Linfociti T
Anche qui le cose non sono facili, visto che la popolazione T è molto complessa e si differenzia ulteriormente in sottopopolazioni chiave nel ruolo della regolazione immunitaria.
I linfociti T sono gli sceriffi e i coordinatori supremi del nostro sistema immunitario, sono il punto di collegamento tra l’immunità innata e l’immunità adattativa e attraverso il loro differenziamento polarizzano in maniera importante il sistema immunitario nella modalità più efficace per affrontare l’enorme numero di minacce che il nostro organismo subisce ogni giorno.
Il comportamento dei linfociti T sotto azione della vitamina D, dipende come abbiamo visto dall’attività delle cellule dendritiche, ma anche dalla cascata immunitaria che deriva dall’attivazione del TCR, che è il recettore dei linfociti T che una volta attivato dal legame con il complesso MHC che presenta l’antigene innesca tutta una serie di reazioni successive.
Linfociti T CD4
I CD4 sono i controllori massimi del sistema, e sono un gruppo piuttosto eterogeneo di cellule. I CD4 possono essere naive, non ancora differenziati, oppure essere già polarizzati in sotto classi:
- Th1: importanti per batteri, virus e patogeni intracellulari
- Th2: importanti per parassiti e miceti
- Th17: specializzati nei patogeni extracellulari e nei miceti, sono anche i più coinvolti nei meccanismi autoimmunitari
- Treg: cellule ad azione regolatoria del sistema immunitario, rilasciano citochine come la IL10 ad attività modulante
Nelle malattie autoimmuni carenza di Treg o iperattivazione di CD4 Th1 e Th17 sono alla base della patologia stessa.
Vediamo nel dettaglio come la vitamina D agisce sulle singole sottopopolazioni:
TH1/TH2
Le cellule Th1 producono IFN-gamma e T-bet, mentre le Th2 IL4-IL5-IL13 oltre al fattore di trascrizione GATA3. Una volta si pensava che queste due categorie fossero particolarmente legate ai fenomeni autoimmuni, questo fino alla scoperta delle cellule Th17, piuttosto recente, e di cui parleremo nella prossima sessione visto che per noi è primario capire questi meccanismi.
Si è visto che la vitamina D diminuisce la produzione di IFN-gamma on “early stage”, ma che più che altro promuove la differenziazione in questo senso diminuendo la polarizzazione TH17, ad oggi ritenuta la grande protagonista della patologia autoimmune.
La vitamina D riduce la produzione di IL2, presentando un effetto immunomodulatorio.
Esistono importanti legami della vitamina D con asma ed allergie e dermatite atopica, ma promettiamo di scriverci un articolo dedicato.
TH17
Ad oggi si concorda sul fatto che questa classe di linfociti sia particolarmente coinvolta nella genesi autoimmune, la produzione citochinica è composta da: IL17A, IL17F, TNF-alfa, GM-CSF.
Si è visto che per la loro attivazione e piena funzionalità è necessario la presenza di IL23.
Basta poco per fare collegamenti farmacologici, ad oggi i più recenti monoclonali sul mercato vanno proprio ad inibire in maniera molto precisa l’IL17 e ancora più recentemente proprio l’IL23. In questo meccanismo anche l’IL12 gioca un ruolo importante, soprattutto nelle artriti, su cui infatti si sta lavorando con farmaci dal doppio blocco IL12-IL23.
I Th17 sono stati trovati molto elevati a livello articolare in tutte le artriti, sia reumatoidi che psoriasiche, in cui promuovono anche l’attività dei fibroblasti sinoviali che a loro volta promuovono l’espressione di enzimi ad attività distruttiva.
La vitamina D gioca un ruolo di enorme regolazione dell’attività TH17, diminuendo la differenziazione in senso Th17, la produzione di IL17a, la diminuzione dei fibroblasti sinoviali ed un minore danno articolare.
Th17.1
Qui entriamo nel campo dell’avanguardia più totale, si è visto che per alcuni meccanismi ancora poco chiari, esista una differenziazione intermedia tra il Th1 ed il Th17, in grado di produrre le citochine di entrambe le classi e tra l’altro in maniera piuttosto massiccia. Si è notato inoltre che la linea di confine tra Th1/17/17.1 non è così netta, e che per meccanismi ancora ignoti sia possibile un passaggio tra queste 3 forme.
Anche qui la vitamina D promuove la differenziazione in Th1 pura, diminuendo le altre due forme, sicuramente ben più connesse allo svilupparsi di fenomeni autoimmuni.
T-REG
Come dice il nome, queste cellule promuovo invece una regolazione immunitaria e sono quelle che tipicamente intervengono al termine di un processo infiammatorio per promuovere la ricostruzione di quanto danneggiato.
La produzione citochinica è data da: IL10 e TGF-beta
Una proteina di espressione fondamentale è FOXP3, si è visto che pazienti con anomalie su questa proteina soffrono di una sindrome chiamata IPEX con fenomeni di autoimmunità massiva.
Si suppone che proprio la perdita di Treg sia un meccanismo chiave nella disregolazione alla base della proliferazione Th17 nella patologia autoimmune e che la vitamina D, promuovendo l’espressione di FOXP3 contribuisca in maniera determinante nell’omeostasi immunitaria.
Si è visto inoltre che FOXP3 sia attivo proprio nell’inibire l’asse autoimmune in maniera specifica, lasciando piena capacità di operare contro patogeni.
A livello molecolare si sono visti 3 diversi meccanismi di azione sui Treg da parte della vitamina D:
- controllando e promuovendo via VDR l’espressione di FOXP3
- inibendo l’iperattivazione del CTLA4 da parte dell’IL17
- Attraverso la produzione di IDO di aumentare il numero di TREG circolanti
Questi 3 effetti combinati concorrono nel ridurre soprattutto i fenomeni di immunità presso il SELF
Conclusioni
Potremmo approfondire ulteriormente descrivendo i meccanismi anche su altre cellule immunitarie che abbiamo volutamente tralasciato, ma pensiamo di essere già troppo specifici così.
Cerchiamo di tradurre tutto a livello pratico, che è quello che poi interessa alla maggior parte delle persone.
A livello pratico è importante arrivare ad un dosaggio di Vit. D nel sangue che consenta il pieno applicarsi dei meccanismi suddetti, non è facile dare un valore di riferimento uguale per tutti, ma per i soggetti autoimmuni il target è più alto che nei sani, secondo noi un valore ideale è 60-80 ng/ml con un Pth nella parte bassa del range.
Vi ricordiamo che secondo le linee guida dell’EFSA il dosaggio massimo sicuro giornaliero che può essere assunto senza controllo medico è fissato come limite MASSIMO a 4000 UI al giorno, oltre al quale si parla di dosaggio farmacologico, che va assunto sotto stretto controllo medico.
Grazie per la pazienza se sei arrivato fino a qui.
Ad Majora