Biodisponibilità dei folati e polimorfismi limitanti della metilazione (5MTHF reduttasi)
In natura e in commercio, sotto forma di integratori, esistono numerose forme di folati a cui è stato dato il nome di vitamina B9.
Negli alimenti, per esempio nelle verdure a foglia verde, troviamo spesso miscele di folati (monoglutammati, poliglutammati ect.) mentre le sostanze utilizzate negli integratori sono monocomponente, prevalentemente acido folico.
Solo il 5-metiltetraidrofolato (5-MTHF) è già attivo e immediatamente utilizzabile dall’organismo.
Tutte le altre forme richiedono una trasformazione enzimatica più o meno complessa con dispendio di energia cellulare sotto forma di ATP.
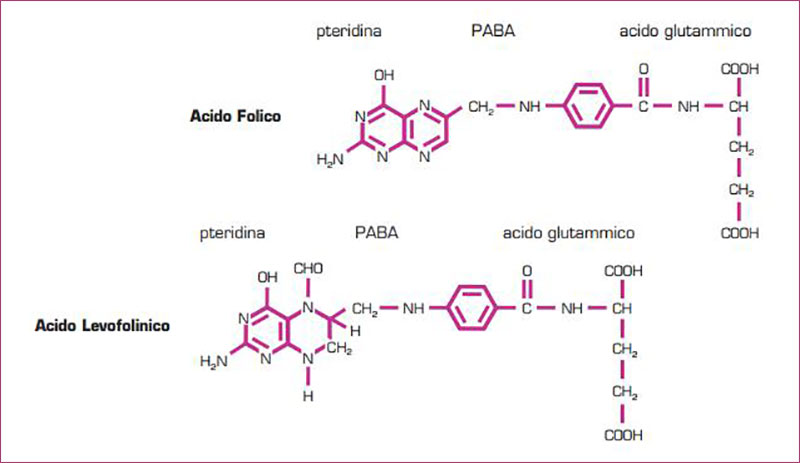
L’acido folico, o acido pteroilglutammico, costituito da un nucleo pteridinico unito all’acido paraminobenzoico e ad una o più molecole di acido glutammico, non è una molecola naturale ma è un prodotto di sintesi. I folati attivi in natura sono quelli che hanno l’anello pteridinico ridotto, ossia i tetraidrofolati (THF).
Alcuni antinutrienti (inibitori della folato-idrolasi), diminuiscono l’assorbimento dei folati dagli alimenti e la successiva trasformazione nella forma attiva:
- Antinutrienti presenti legumi -20%
- Antinutrienti presenti nel succo di arancia -80%
L’acido folico non è quindi metabolicamente attivo e per avere un effetto biologico deve subire 5 trasformazioni nell’intestino e nel fegato.
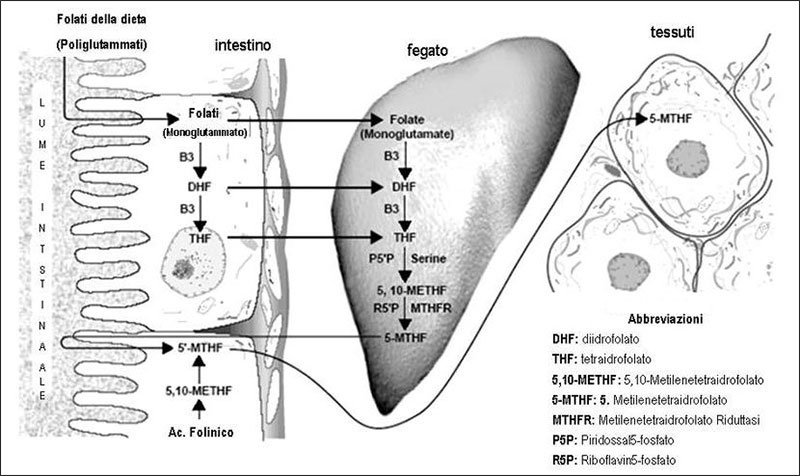
Si tratta di 4 reazioni di idrossilazione e una metilazione.
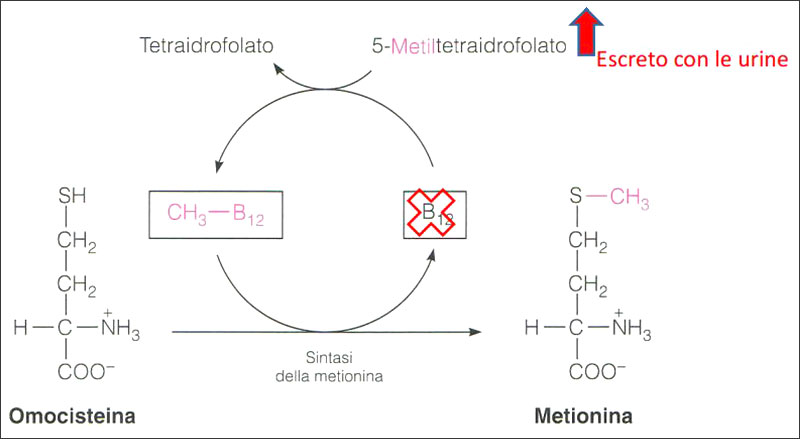
Gli intermedi sono il diidrofolato (DHF), il tetraidrofolato (THF) il 5,10-metilentetraidrofolato (5,10-MTHF) e solo dopo la metilazione finale si arriva alla forma attiva: 5-metiltetraidrofolato (5-MTHF).
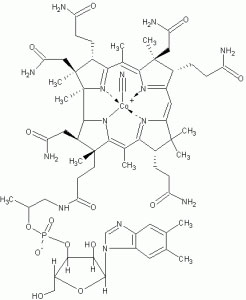
La metilazione viene catalizzata dalla metilentetraidrofolatoreduttasi (MTHFR) e richiede la presenza e l’aiuto di un’altra vitamina del gruppo B la B12 in forma attiva: ovvero la metilcobalamina.
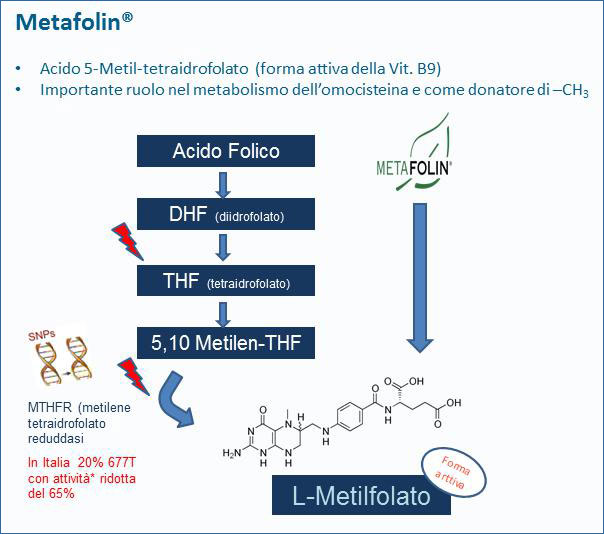
La somministrazione di acido folico può presentare quindi alcuni inconvenienti, come la ridotta biodisponibilità con accumulo di metaboliti intermedi potenzialmente dannosi soprattutto nel caso di dosaggi elevati.
L’acido folinico (levofolinico) è già più avanti nel processo di costruzione della forma attiva ma si tratta ancora ad una PRO-VITAMINA.
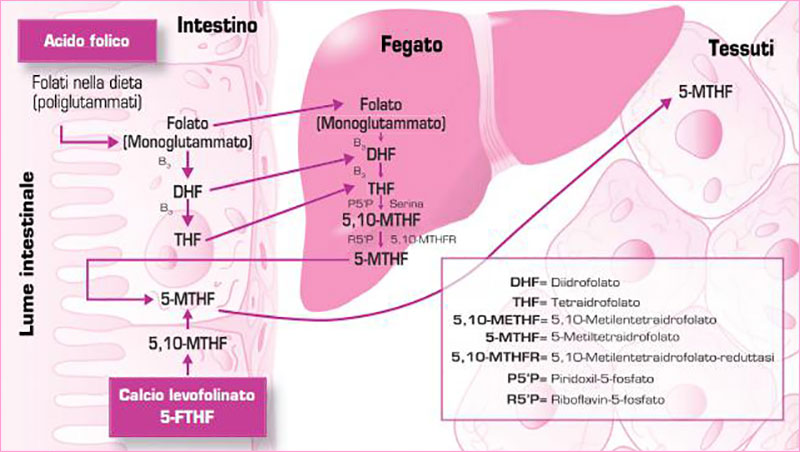
L’acido folinico deve in realtà superare il passaggio più difficile per diventare B9 attiva: la metilazione. A questo punto potremmo trovare la barriera del deficit genetico dell’enzima di trasformazione: la 5MTHF reduttasi.
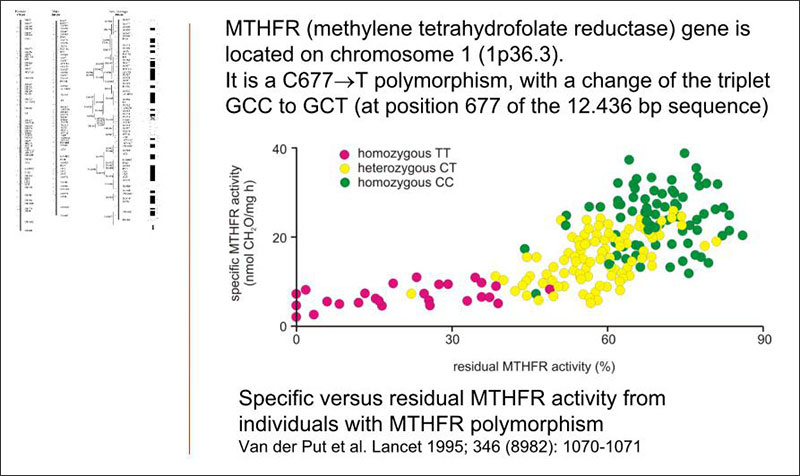
Nel 1991 è stata scoperta una variante termolabile dell’enzima MTHFR, la variante genetica C677T, che correlava positivamente con le patologie coronariche arteriose.
Tale variante promuove la trascrizione di una forma enzimatica diversa da quella normale per la sostituzione di una Alanina con una Valina nella sua catena amminoacidica e ciò corrisponde sulla sequenza genica ad una transizione da Citosina a Timina in posizione 677.
Il gene che codifica per questo enzima ha un polimorfismo di singolo nucleotide (SNP) con forma omozigote a bassa attività. In questa forma l’attività enzimatica è ridotta di oltre il 60-70% con una incidenza nella popolazione italiana di circa il 20-30%, con punte regionali del 35% nelle regioni meridionali. La forma eterozigote è generalmente attiva all’80-90%.
Esistono altri polimorfismi limitanti nel metabolismo dei folati ma con un impatto minore sui processi biochimici del ciclo dei folati e di conseguenza sul ciclo dell’omocisteina e dei processi di metilazione. I più importanti sono:

Tra questi segnaliamo il (SNP) A1298C che può avere un significativo impatto sulla salute soprattutto quando la forma limitante è in compresenza con la mutazione del C677.
Test genetici
E’ consigliabile effettuare un test di laboratorio per verificare la presenza delle mutazioni C677T e A1298C del gene MTHFR nei seguenti casi, eventualmente allargando ai parenti diretti l’indagine:
- Malattie cardiovascolari premature o frequenti eventi CV maggiori in famiglia
- Trombo-embolismo venoso (trombosi venosa, embolia polmonare)
- Prima di assumere contraccettivi orali
- Poli-abortività o difficoltà ad avviare una gravidanza
- Infertilità maschile
- Necessità di trattamento con metotrexato o chemioterapici
- Aterosclerosi precoce
- Malattie autoimmuni, reumatologiche, MICI
Il costo del test genetico per il SNP C677 del gene MTHFR è circa 70 euro (fonte IMGeP-Milano) e come tutti i test genetici si effettua una sola volta nella vita.
Test ematici
Si possono misurare in laboratorio i valori di folati nel siero e negli eritrociti. Solitamente i valori eritrocitari NON vengono effettuati, perché le carenze plasmatiche portano rapidamente ad una carenza eritrocitaria; quindi una positività al primo esame rende inutile il secondo.
Valori di norma dei folati sierici sono 3-30 nmol/l ma vengono considerati patologici (indicatori di carenza) livelli inferiori a 7nmol/l. Valori superiori alla norma sono molto rari e dovuti principalmente ad un sovradosaggio terapeutico o integrativo.
Carenze genetiche limitanti del metabolismo dei folati e conseguenze
Le mutazioni genetiche limitanti degli enzimi collegati al metabolismo dei folati si associano ad una ridotta attività enzimatica con elevati livelli ematici di omocisteina (iperomocisteinemia), particolarmente nei soggetti il cui apporto dietetico di folati non è ottimale, e una diminuzione dei livelli circolanti di folati. I livelli plasmatici di omocisteina arrivano in certi casi a superare di 4 volte i livelli di norma.
Questo fenomeno è stato identificato come fattore di rischio per lo sviluppo di:
- Trombosi arteriosa
- Malattie coronariche
- Difetti nel tubo neurale
- Aborti spontanei
- Patologie autoimmuni
- Emicrania
- Depressione e schizofrenia
La progressione delle carenze di folati e sue conseguenze
La carenza di folati avviene in 4 stadi differenziabili attraverso semplici test ematici e con un’accurata l’anamnesi.
Nel primo stadio avviene una deplezione dei folati circolanti misurabile con il test dei folati sierici.
Poi (II stadio) comincia la deplezione delle riserve cellulari (principalmente epatiche) che solitamente ammontano a circa 20 mg. Nel III stadio cominciano le alterazioni del metabolismo dell’omocisteina evidenziabili anche questi con semplici e poco costosi test di laboratorio (Omocisteinemia e MMA).
Tenendo conto che il fabbisogno giornaliero è di 50 µg circa (aumenta anche di molto in alcune situazioni, prima tra tutte la gravidanza) la carenza di folati si sviluppa entro pochi mesi dalla riduzione dell’apporto dietetico, al contrario di quella di B12 che ha un processo molto più lento.
Solo nel IV stadio cominciano i sintomi che possono essere:
- Anemia megaloblastica (la maggior parte delle quali è dovuta a carenza di B9 o B12)
- Problemi gastrointestinali
- Disordini neurologici e psichiatrici
- Malattie cardiovascolari
- Cancro (colon-retto e polipi adenomatosi)
- In gravidanza: Nascite premature , Neonato sottopeso , Ritardo mentale, Difetti tubo neurale (spina bifida, anencefalia)

Alterazioni nel metabolismo dei folati possono scatenare o aggravare patologie reumatologiche o dermatologiche (come la psoriasi) e accelerare i processi di invecchiamento in quanto la metilazione è uno passaggi chiave di tutto il metabolismo cellulare.
Anche alcuni fattori legati agli STILI di VITA possono avere un’influenza negativa sul metabolismo dei folati e dell’omocisteina: tabagismo, abuso di sostanze alcoliche e caffeina, scarsa attività fisica e alimentazione povera di frutta e verdura (soprattutto quella a foglia verde).
Metabolismo dei folati e farmaci
I polimorfismi del MTHFR possono modificare la farmacodinamica degli antifolati (sostanze che agiscono come analoghi) come ad esempio del metotrexato e di molti altri farmaci il cui metabolismo, i cui effetti biochimici o i cui bersagli richiedono reazioni di metilazione, come chemioterapici, antineoplastici ed antireumatici.
Il metotrexato e le aminopterine possono aggravare una carenza alimentare o genetica di folati.
Altre vitamine e minerali utili nel dismetabolismo dei folati
Come detto in precedenza la metilcobalamina (forma attiva della Vit.B 12) gioca un ruolo importante nel metabolismo dei folati. Altre vitamine coinvolte sono la riboflavina (Vit B2) e la Vitamina B6.
Magnesio, ferro, zinco e selenio sono i minerali la cui carenza può interferire con i processi di metilazione e il metabolismo dei folati in quanto cofattori di importanti enzimi di trasformazione.
La “trappola dei folati”
Carenze importanti di vitamina B12 possono indurre carenze di folati e favorire il dismetabolismo nel ciclo dell’omocisteina e nei processi di metilazione. Questo processo è noto come “trappola dei folati”. Molte anemie sideropeniche resistenti alla integrazione di ferro dipendono da carenze di folati (o di rame). La maggior parte delle anemie megaloblastiche sono dovute a carenza di folati.
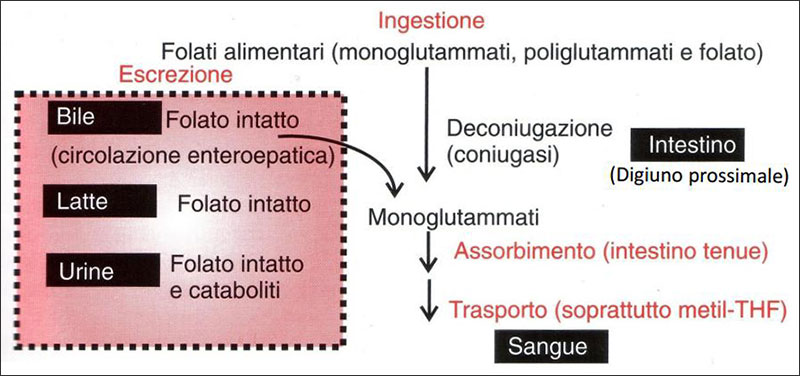
Assorbimento e metabolismo dei folati: informazioni aggiuntive
I folati alimentari sono convertiti nella forma mono-glutammica da coniugasi (folilpoliglutammatoidrolasi) sull’orletto a spazzola del digiuno (a pH neutro). L’assorbimento è quindi influenzato dal pH intestinale.
Il trasporto all’interno dell’enterocita avviene grazie ad un trasportatore pH dipendente. L’utilizzo di antiacidi o di IPP può interferire con i meccanismi di assorbimento dei folati come anche di numerosi altri micronutrienti.
La riduzione e metilazione, passaggi chiave dell’attivazione dei precursori della vit.B9 attiva, avvengono nell’enterocita.
Esiste anche un meccanismo passivo di assorbimento, non saturabile, che funziona a concentrazioni elevate di folati. Nel plasma i folati vengono veicolati come 5-metil-THF, legato all’albumina.
Consigli generali
Una dieta sana e varia è generalmente sufficiente a fornire un adeguato apporto di folati per le esigenze normali dell’organismo, ma questo avviene solo in una parte della popolazione generale.
L’apporto può risultare inadeguato e quindi necessita integrare, nei casi di deficit genetici, malassorbimento, nelle donne fertili che programmano una gravidanza, in gravidanza e allattamento, in chi consuma alcol, antinutrienti e farmaci analoghi dei folati, nelle MICI.
Solo l’integrazione con 5-metiltetraidrofolato (5-MTHF) è in grado di superare i polimorfismi genetici e di garantire a tutti una forma di vitamina B9 già attiva ed in grado di esercitare le sue funzioni biologiche senza bisogno di ulteriori trasformazioni.
Il 5-metiltetraidrofolato (5-MTHF) è in grado di passare la barriera ematoencefalica e placentare e può quindi arrivare al feto e contribuire alla corretta chiusura del tubo neurale nelle prime settimane di gravidanza. In Italia nascono ogni anno oltre 500 bambini con spina bifida (difetto di chiusura del tubo neurale) solo per una carenza di vitamina B9 nel periodo del concepimento.
È incredibile e inaccettabile come in un paese industrializzato come l’Italia possano persistere patologie così gravi e invalidanti la cui prevenzione si attua con una semplice integrazione a costi molto contenuti.
Ci auguriamo che in futuro un approccio più consapevole alla nutrizione e all’integrazione di qualità consenta ad ogni soggetto di vivere una vita sana e felice, sviluppando al massimo il suo potenziale genetico.
A cura di: Dott. Maurizio Salamone
Laurea in Biologia e in Scienze MM.FF. e Naturali. Responsabile scientifico di Metagenics Italia